Intervenir tempranamente con BLINCYTO ®
EMR(+): El estudio fundamental BLAST
Diseño del estudio: N = 86, un estudio de fase 2, abierto, de un solo grupo, de pacientes adultos con LLA precursora de células B con EMR(+) que habían recibido al menos 3 bloques de quimioterapia de la terapia estándar para LLA y se encontraban en remisión hematológica completa ( definido como < 5 % de blastos en la médula ósea, recuento absoluto de neutrófilos > 1 Gi/l, plaquetas > 100 Gi/l) y tenía EMR* a un nivel de ≥ 0,1 % usando un ensayo con una sensibilidad mínima de 0,01 %. Criterio de valoración principal: en el 81 % (n=70/86) de los pacientes no se evaluó EMR detectable después de 1 ciclo de tratamiento con BLINCYTO ® .* Criterios de valoración secundarios seleccionados: SG, SSR hematológica a los 18 meses, duración de la remisión hematológica. 1,2
BLINCYTO ® (blinatumomab) es un enfoque establecido para lograr la negatividad de la EMR en las primeras etapas de la consolidación de primera línea
*Definido como la ausencia de EMR detectable confirmada en un ensayo con una sensibilidad mínima de 0,01 % para 6 pacientes y ≤ 0,005 % para 80 pacientes. 65 de 80 pacientes lograron una EMR indetectable con una sensibilidad del ensayo de al menos 0,005%. 1
En el estudio BLAST, la mayoría de los pacientes lograron una EMR negativa con BLINCYTO ®
Criterio de valoración principal: respuesta completa de EMR*
81%
(n=70/86)
de los pacientes no tenían EMR detectable †
- La respuesta completa de enfermedad residual medible (EMR) fue similar en todos los subgrupos de pacientes (edad, historial de recaídas y carga de EMR) 2
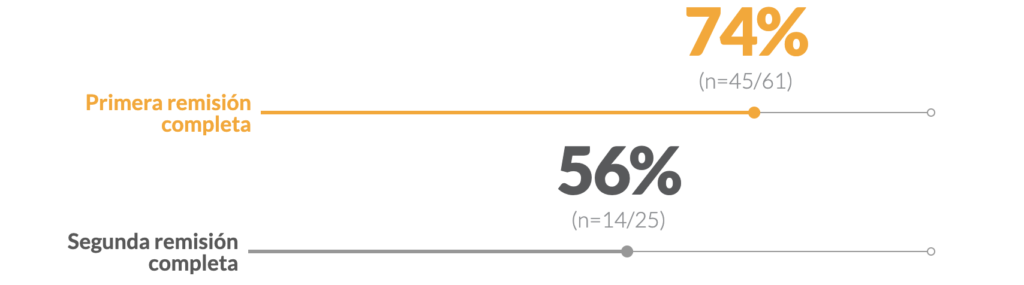
Porcentaje de pacientes que procedieron a un trasplante alogénico de células madre hematopoyéticas (TCMH) 1
*Definido como la ausencia de EMR detectable confirmada en un ensayo con una sensibilidad mínima de 0,01% para 6 pacientes y ≤ 0,005% para 80 pacientes. 65 de 80 pacientes lograron una EMR indetectable con una sensibilidad del ensayo de al menos 0,005%. 1
†Evaluado después de 1 ciclo de tratamiento. 1
ALL, leucemia linfoblástica aguda; EMR, enfermedad residual medible o mínima; NCCN, Red Nacional Integral del Cáncer; SG, supervivencia general; SLR, supervivencia libre de recaídas.
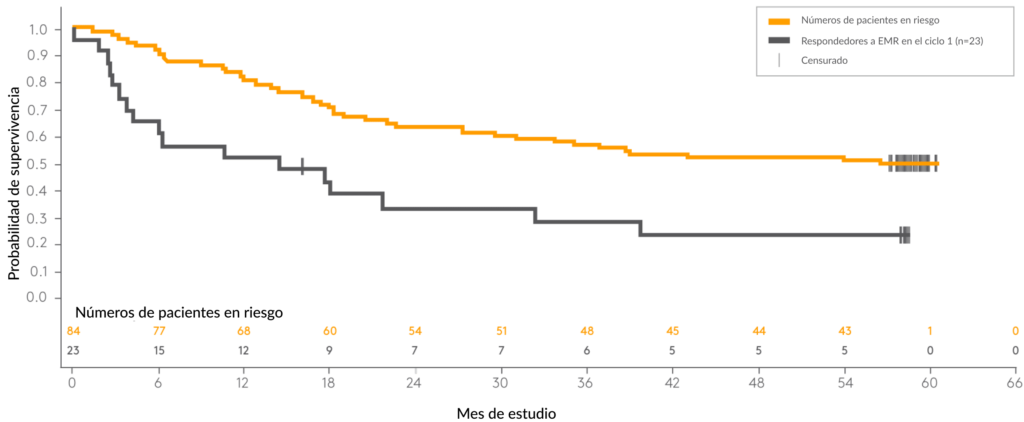
A los 5 años, aún no se había alcanzado una mediana de SG para los pacientes que alcanzaron una EMR negativa
Mediana de SG en pacientes con y sin respuesta completa a EMR ‡
| Respuesta del paciente | norte | SG mediana | IC del 95% |
| Respondedores de EMR en el ciclo 1 | 84 | No. | 29.5–NO |
| EMR que no responden en el ciclo 1 | 23 | 14,4 meses | 3,8–32,3 |
- La mediana de seguimiento de la SG fue de 59,8 meses 3
- No se ha demostrado un beneficio para la SG en un ensayo controlado y aleatorizado.
- Debido al efecto diferencial del TCMH sobre la SG, la interpretación de los resultados de la SG no puede excluir posibles factores de confusión del TCMH 2
- Se desconoce si lograr por sí solo la negatividad de la EMR proporciona un beneficio de SG comparable al del TCMH. Por lo tanto, el beneficio de supervivencia no puede limitarse únicamente al tratamiento con BLINCYTO ®
- En el estudio BLAST, la SG no fue un objetivo principal y el estudio no tuvo el poder para evaluar la eficacia de la SG 2
- La mediana de SG fue de 36,5 meses (IC del 95 %: 22,0–NE) en general † después del tratamiento con BLINCYTO ® y alcanzó una meseta 3
- La mediana de SG no fue estimable (es decir, no se alcanzó) entre los subconjuntos de pacientes que lograron una respuesta completa de EMR con BLINCYTO ® en la primera remisión completa o que procedieron a un TCMH en CCR 3 .
Consulte los datos de seguridad de BLINCYTO ® en pacientes con LLA de precursores de células B con EMR(+)
†La SG se evaluó en pacientes con LLA de precursores de células B Ph(–) con menos del 5 % de blastos en el momento de la inscripción, e incluye 74 pacientes que recibieron TCMH mientras estaban en RCC después de BLINCYTO ® . Los análisis de SG por respuesta completa de EMR después del ciclo 1 incluyeron a 107 pacientes, de los cuales se excluyeron los pacientes sin ensayo central de EMR (n=1) o con una sensibilidad inadecuada de la prueba de EMR (n=2). 3
‡Los pacientes de esta población difieren de la población del USPI. El análisis incluye pacientes adicionales: aquellos que alcanzaron RCh* y RCi y/o están en 3RC. 1,2,4,5
RCC: remisión completa continua; IC: intervalo de confianza; 3RC, tercera remisión completa; RCh*: remisión completa con recuperación hematológica parcial; RCi: remisión completa con recuperación hematológica incompleta; NE, no estimable; NA, no alcanzado; Ph(–), cromosoma Filadelfia negativo; USPI, Información de prescripción de Estados Unidos.
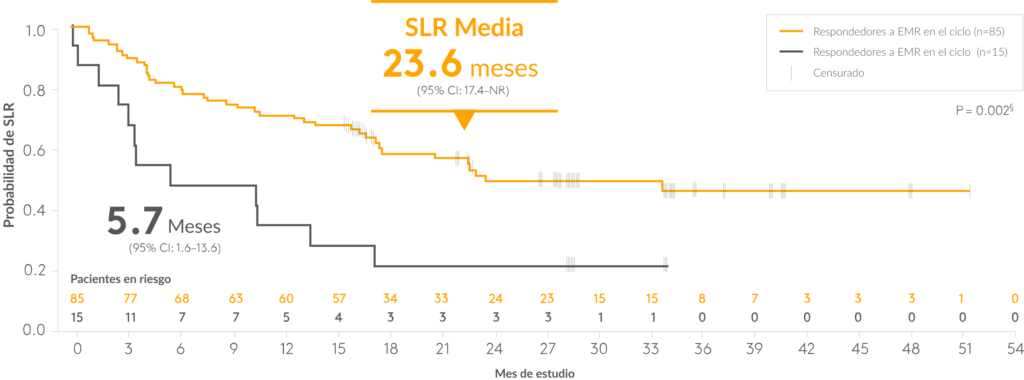
En el estudio fundamental BLAST, los pacientes †,‡ que lograron negatividad para la EMR tuvieron una SLR significativamente más prolongada 2,6
Supervivencia libre de recaída (SLR) § en pacientes con y sin respuesta completa a EMR** ,††
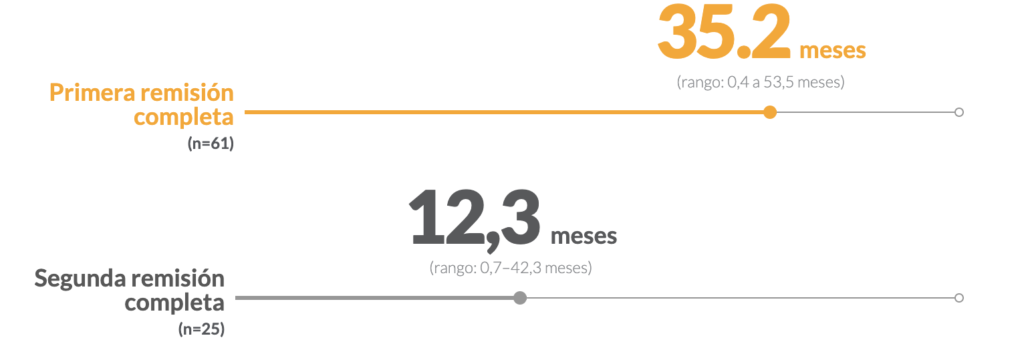
Mediana de SLR ‡‡ en pacientes §§ que fueron tratados con EMR(+) en la primera remisión completa frente a la segunda remisión completa
Utilice BLINCYTO ® en las primeras etapas de consolidación de primera línea para lograr una EMR negativa y permitir que los pacientes vivan sin enfermedades por más tiempo
†Los pacientes de esta población difieren de la población del USPI. El análisis incluye los siguientes pacientes adicionales: aquellos que alcanzaron RCh* y RCi, y/o están en CR3. 1,2,4,5
‡El análisis de puntos de referencia incluyó a pacientes tanto en el conjunto de análisis completo secundario clave como en el conjunto de análisis de criterios de valoración primarios del estudio BLAST y excluye a los pacientes con un evento (muerte o recaída) o censurados antes del día 45; pacientes sin resultados de EMR (n=1); o sensibilidad insuficiente del ensayo (n=2). 2
- Se utilizaron estimaciones de Kaplan-Meier con IC bilaterales del 95 % para describir la SLR; Las diferencias entre subgrupos se evaluaron mediante la prueba de rangos logarítmicos. 2
**De los pacientes del conjunto clave de análisis completo secundario, el 67 % (74 de 110) se sometió a un TCMH en remisión continua. 2
††La mediana de la SLR fue de 23,6 meses para los que respondieron a la EMR (n = 70) frente a 10,6 meses (n = 16) para los que no respondieron, según un análisis exploratorio de la población del USPI. 5 , ‡
‡‡La recaída se definió como recaída hematológica o extramedular, leucemia secundaria o muerte por cualquier causa; incluye tiempo después del trasplante; Estimación de Kaplan-Meier. 1
- §El 74% (45/61) de los pacientes en la primera remisión completa y el 56% (14/25) de los pacientes en la segunda remisión completa se sometieron a un TCMH. 1
Diseño del estudio BLAST y características basales de los pacientes.
Diseño del estudio BLAST: estudio de fase 2 de un solo grupo del tratamiento con BLINCYTO ® para pacientes adultos con LLA de precursores de células B EMR(+) 1,2,4

Criterio de valoración principal:2
- Respuesta completa de EMR † después de 1 ciclo de tratamiento
Criterio de valoración principal :2
- SO
- SLR hematológica a los 18 meses
- Duración de la remisión hematológica.
Diseño del estudio BLAST: estudio de fase 2 de un solo grupo del tratamiento con BLINCYTO ® para pacientes adultos con LLA de precursores de células B EMR(+) 1,2,4
| Criterios de inclusión clave1 |
|---|
| Adultos ≥ 18 años con LLA de precursores de células B en remisión hematológica completa |
| Enfermedad residual medible (EMR)‡ nivel de ≥ 0,1% (molecular recaída o fallo molecular)§ |
| < 5% de blastos en médula ósea |
| ANC> 1 Gi/L |
| Plaquetas> 100 Gi/L |
| Criterios de exclusión clave4 |
| TCMH previo |
| Presencia de blastos circulantes o enfermedad extramedular actual. |
| Historia de patología relevante del SNC o patología relevante del SNC actual |
| Quimioterapia sistémica previa contra el cáncer dentro de las 2 semanas o radioterapia dentro de las 4 semanas |
La mayoría de los pacientes se encontraban en la primera remisión completa al inicio1
| Características basales de los pacientes (N=86) | |
|---|---|
| Edad | |
| Mediana, años (mín, máx) | 43 (18, 76) |
| ≥ 65 años, n (%) | 10 (12) |
| Hombres, n (%) | 50 (58) |
| Estado de la enfermedad del cromosoma Filadelfia, n (%) | |
| Positivo | 1 (1) |
| Negativo | 85 (99) |
| Historia de recaída, n (%) | |
| En primera remisión completa | 61 (71) |
| En segunda remisión completa | 25 (29) |
| Niveles iniciales de EMR,* norte (%) | |
| ≥ 10% | 7 (8) |
| ≥ 1% y < 10% | 34 (40) |
| ≥ 0,1% y < 1% | 45 (52) |
Según lo determinado por un ensayo con una sensibilidad mínima del 0,01%.
Definido como la ausencia de EMR detectable confirmada en un ensayo con una sensibilidad mínima de 0,01% para 6 pacientes y ≤ 0,005% para 80 pacientes. 65 de 80 pacientes lograron una EMR indetectable con una sensibilidad del ensayo de al menos 0,005%. 1
También conocida como enfermedad residual mínima.
§En un ensayo con una sensibilidad mínima del 0,01 %, nivel de EMR de ≥ 0,1 % después de ≥ 3 tratamientos de quimioterapia intensiva
RAN: recuento absoluto de neutrófilos; SNC, sistema nervioso central; IV, intravenoso.

Blinatumomab (BLINCYTO®) es el único NCCN Directrices: opción de tratamiento recomendada en consolidación para pacientes adultos con LLA de precursores de células Ph(-) B que tienen persistencia o aumento de la EMR; las Directrices de la NCCN recomiendan «terapia dirigida a eliminar la ERM antes del TCH alogénico», cuando sea posible.?
R/R: El estudio emblemático TOWER

Diseño del estudio: un estudio de fase 3 grande (N=405), internacional, aleatorizado, controlado, de BLINCYTO como agente único® vs. Quimioterapia SOC en pacientes ≥ 18 años: refractaria a la terapia de inducción primaria o a la última terapia, en la primera recaída (duración de la primera remisión <12 meses), en la segunda o posterior recaída, o en cualquier recaída después de un TCMH. El criterio de valoración principal fue mOS: 7,7 meses para BLINCYTO® (n=271) frente a 4,0 meses para quimioterapia SOC (n=134); P = 0,012; HR: 0,71 (IC 95 %: 0,55–0,93).1 Criterios de valoración secundarios seleccionados: RC dentro de las 12 semanas posteriores al inicio del tratamiento, CR/CRh*/ RCi dentro de las 12 semanas posteriores al inicio del tratamiento, tasa de remisión de EMR, duración de la remisión, tasas de eventos adversos.1,8
BLINCYTO® es un enfoque establecido para minimizar la quimioterapia que mejoró significativamente la supervivencia en comparación con la quimioterapia SOC
BLINCYTO® casi duplicó la mediana de supervivencia general frente a quimioterapia SOC
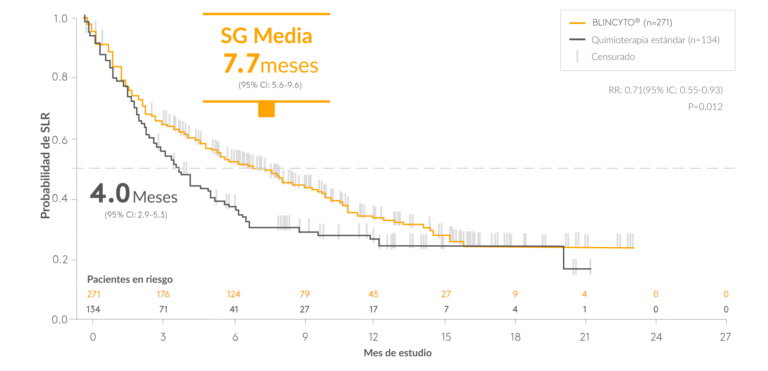
*Un sujeto censurado se indica mediante una línea vertical barra.1
ALL, leucemia linfoblástica aguda; IC: intervalo de confianza; RC: remisión completa; DOR: duración de la respuesta; HR: índice de riesgo; HCT, trasplante de células hematopoyéticas; TCMH, trasplante alogénico de células madre hematopoyéticas; mOS, mediana de supervivencia global; EMR, enfermedad residual medible o mínima; NCCN, Red Nacional Integral del Cáncer; SG, supervivencia general; Ph(–), cromosoma Filadelfia negativo; CV, calidad de vida; R/R, recaída o refractaria; SOC, estándar de atención.
La intervención con BLINCYTO® en el primer rescate duplicó con creces la mediana de SG frente a la quimioterapia SOC
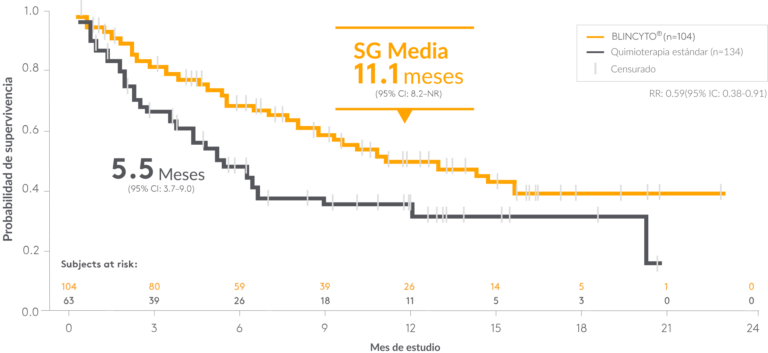
*La SG en pacientes tratados en el primer rescate fue un análisis de subgrupo preespecificado en TOWER; sin embargo, la eficacia de la SG en este subgrupo no fue un objetivo del estudio y el estudio no tuvo el poder estadístico suficiente para evaluar la eficacia de la SG en este subgrupo10
Un sujeto censurado se indica mediante una línea vertical barra.9
NR, no alcanzado
BLINCYTO® demostró una mejor supervivencia general en pacientes que no se sometieron a un TCMH
Los pacientes que no se sometieron a un TCMH aún lograron un beneficio de SG cuando fueron tratados con BLINCYTO

*La SG en pacientes censurados para trasplante alogénico fue un análisis de subgrupo de sensibilidad preespecificado en TOWER; sin embargo, la eficacia de la SG en este subgrupo no fue un objetivo del estudio y el estudio no tuvo el poder estadístico suficiente para evaluar la eficacia de la SG en este subgrupo.10
Los pacientes que recibieron BLINCYTO® lograron tasas más altas y una mayor duración de la remisión en comparación con Quimioterapia SOC

Duración media de la remisión para los pacientes que alcanzaron CR/CRh*/CRi 8

- Tasas de RC/CRh*/CRi alcanzadas dentro de las 12 semanas posteriores al tratamiento iniciación8
- 53% (n=60/114) de los pacientes en primer rescate tratados con BLINCYTO® logrado CR/CRh*/CRi8
- CR/CRh*/CRi en pacientes tratados en primer rescate fue un análisis de subgrupos preespecificados en TOWER; sin embargo, el CR/CRh*/CRi en esto El subgrupo no era un objetivo del estudio y el estudio no tenía poder estadístico. para evaluar la eficacia en este subgrupo
CR se definió como ≤ 5% de explosiones en la MO, sin evidencia de enfermedad y con recuperación completa de la sangre periférica cuenta (plaquetas> 100.000/microlitro y RAN> 1.000/microlitro). CRh* fue definido como ≤ 5% explosiones en la MO, sin evidencia de enfermedad y recuperación parcial de Sangre periférica recuentos (plaquetas> 50.000/microlitro y RAN> 500/microlitro). CRi fue definido como ≤ 5% de explosiones en la MO, sin evidencia de la enfermedad y recuperación incompleta de los recuentos sanguíneos periféricos. (plaquetas> 100.000/microlitro o ANC> 1.000/microlitro).8
RAN: recuento absoluto de neutrófilos; MO, médula ósea; RCh*: remisión completa con recuperación hematológica parcial; RCi: remisión completa con recuperación hematológica incompleta.
Los pacientes que recibieron BLINCYTO® lograron tasas más altas y una mayor duración de la remisión en comparación con Quimioterapia SOC
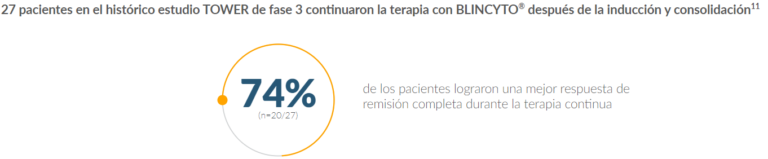
- Pacientes que recibieron BLINCYTO® y tuvieron blastos en la médula ósea ≤ 5% después de la inducción (hasta 2 ciclos) y consolidación (hasta 3 ciclos) con BLINCYTO® fueron elegibles para recibir terapia continua durante 12 meses adicionales (4 semanas de tratamiento, 8 semanas de descanso)11
- En el momento de la recopilación de datos de los pacientes que recibían tratamiento continuo, 11 pacientes continuaban el tratamiento con BLINCYTO®, mientras que 16 habían interrumpido el tratamiento debido a: finalización de la terapia de mantenimiento (n=3); intención de recibir TCMH (n=4); intención de recibir tratamiento distinto del TCMH (n = 2); recaída (n=6); o un EA (n=1)11
- Durante la terapia continua de los ciclos 6 a 9, no se identificaron nuevos problemas de seguridad; Los EA que surgieron durante el tratamiento incluyeron:11
- 4 pacientes tuvieron un evento neurológico
- 1 paciente tenía síndrome de liberación de citocinas (SLC)
- En general, las tasas de eventos de seguridad fueron más bajas en los ciclos de terapia continua que en los ciclos de inducción o consolidación11
Los pacientes tratados con BLINCYTO® tuvieron mayores tasas de negatividad de EMR† que los pacientes tratados con Quimioterapia SOC
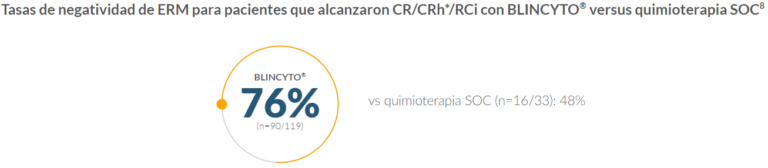
Ver los datos de seguridad del estudio TOWER
†La remisión molecular se evaluó en pacientes que alcanzaron CR/CRh*/CRi y se definió como EMR mediante PCR o citometría de flujo con una sensibilidad mínima del ensayo de < 1 x 10–4.8
PCR, reacción en cadena de la polimerasa.
BLINCYTO® diferencias en las medidas de CVRS desde el inicio frente a la quimioterapia SOC
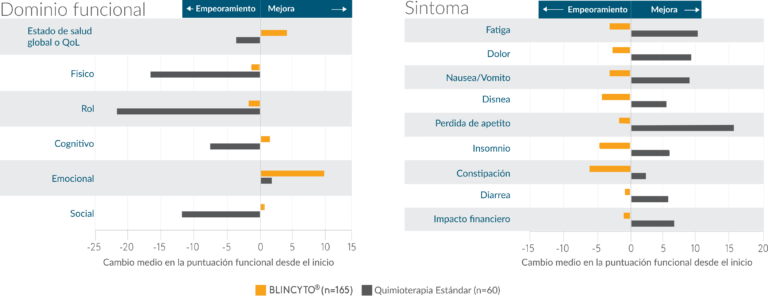
- Estos datos provienen de un análisis de un criterio de valoración descriptivo secundario de un estudio de fase 3. El criterio de valoración midió el cambio desde el inicio de las puntuaciones de un instrumento PRO* validado durante el primer ciclo de tratamiento13
- El estudio no tuvo la potencia necesaria para evaluar las diferencias estadísticas en las medidas de calidad de vida entre BLINCYTO® y los grupos de tratamiento de quimioterapia SOC13
- Las tasas de EA seleccionadas para pacientes tratados con BLINCYTO® fueron fatiga (12,7%), dolor de espalda (13,1%), náuseas (19,1% ), vómitos (12,4%), insomnio (10,5%), estreñimiento (12,7%) y diarrea (21,7%)14
Haga clic aquí para acceder al cuestionario de calidad de vida de la EORTC del estudio TOWER
*El instrumento PRO, el Cuestionario de Calidad de Vida de la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC QLQ-C30), es un cuestionario de autoevaluación validado que se utiliza para evaluar las percepciones de los pacientes sobre la eficacia del tratamiento en oncología. 13
EA, evento adverso; CVRS, calidad de vida relacionada con la salud; PRO, resultado informado por el paciente.
Diseño del estudio TOWER y características basales de los pacientes
- Estudio histórico de fase 3 de TOWER: BLINCYTO® se comparó la inmunoterapia como agente único con la quimioterapia SOC en un gran ensayo de fase 3, internacional, prospectivo, aleatorizado y controlado. de 405 pacientes con LLA de precursores de células B Ph(–) R/R1

Tratamiento previo a la fase:
- Todos los pacientes con> El 50% de los blastos de médula ósea recibieron dexametasona (10 mg/m2/día hasta un máximo de 24 mg/día) antes de la aleatorización para reducir el riesgo de RSC asociado con una alta carga tumoral:1
- El 14 % (n=37/267) de los pacientes tratados con BLINCYTO® experimentaron RSC de cualquier grado, y el 3% (n=8/267) experimentó ≥ Grado 316
Premedicación:
- Los pacientes tratados con BLINCYTO ® fueron premedicados ‡ con 20 mg de dexametasona 1 hora antes de la infusión 1,16
†Mantenimiento según lo definido por el protocolo del estudio: pacientes que alcanzan ≤ Las voladuras de 5% de BM podrían continuar con BLINCYTO® como terapia de mantenimiento durante 12 meses adicionales (4 semanas después, 8 semanas apagado).8
‡Los pacientes fueron premedicados antes de cada ciclo, antes de una dosis escalonada (como el ciclo 1 día 8) y al reiniciar una infusión después de una interrupción de 4 o más horas.1
Criterio de valoración principal:
- SO
Criterios de valoración secundarios seleccionados:
- RC dentro de las 12 semanas posteriores al inicio del tratamiento
- CR/CRh*/CRi dentro de las 12 semanas posteriores al inicio del tratamiento
- Tasa de remisión de EMR
- Duración de la remisión
- Tasas de eventos adversos
| Criterios de inclusión clave |
|---|
| Pacientes ≥ 18 años |
| Ph(–) R/R precursor de células B TODOS que se presentan como refractarios a la terapia de inducción primaria o a la última terapia, o primera recaída no tratada (duración de la primera remisión <12 meses), o en una segunda o posterior recaída, o en cualquier recaída después del TCMH |
| Con > 5% explosiones en el BM y ECOG PS ≤ 2 |
| Criterios de exclusión clave |
| Otros cánceres activos |
| Condición patológica clínicamente relevante del SNC. |
| Enfermedad extramedular aislada |
| Enfermedad autoinmune |
| GvHD aguda de grado ≥ 2, GvHD crónica activa |
| Alotrasplante de células madre dentro de las 12 semanas anteriores aleatorización |
| Autotrasplante de células madre dentro de las 6 semanas anteriores aleatorización |
| Quimioterapia o radioterapia dentro de las 2 semanas anteriores. aleatorización |
| Uso de inmunoterapia dentro de las 4 semanas previas a la aleatorización |
| Uso continuo del tratamiento en investigación. |
BLINCYTO® se estudió en una amplia gama de pacientes adultos, incluidos aquellos con mal pronóstico
Características basales de la población de estudio1,8
| BLINCYTO® (N=271) | SOC Quimioterapia (N=134) | |
| Edad | ||
| Media ± DE, años | 41 ± 17 | 41 ± 17 |
| Rango, años | 18–80 | 18–78 |
| Criterios de ingreso al estudio, n (%) | ||
| Refractario al tratamiento primario o de rescate. | 115 (42) | 54 (40) |
| En la primera recaída temprana (duración de CR1 <12 meses) | 76 (28) | 37 (28) |
| En segunda o posterior recaída no tratada§ | 32 (12) | 16 (12) |
| Recaída después de TCMH§ | 46 (17) | 27 (20) |
| No especificado | 2 (1) | 0 |
| Terapia de rescate previa, n (%) | 171 (63) | 70 (52) |
| Trasplante previo, n (%) | ||
| Sí | 94 (35) | 46 (34) |
| No | 176 (65) | 87 (65) |
| Desconocido | 1 (0) | 1 (1) |
| Carga de enfermedad, n (%) | ||
| ≥ 50% de explosiones de MO | 201 (74) | 104 (78) |
Los pacientes que cumplieron con este criterio de ingreso al estudio no cumplieron ninguno de los criterios de ingreso al estudio anteriores.8
- Pacientes con primera recaída tardía (≥ 12 meses después de la primera remisión) fueron excluidos8
SNC, sistema nervioso central; CR1, primera remisión completa; ECOG PS: puntuación de desempeño del Grupo Cooperativo de Oncología del Este; FLAG, fludarabina, citarabina, factor estimulante de colonias de granulocitos; GvHD, enfermedad de injerto contra huésped; HiDAC, citarabina en dosis altas; HR: índice de riesgo; IV, intravenoso; DE, desviación estándar.

Blinatumomab (BLINCYTO°) es un medicamento de Categoría
R/R: estudio de evidencia del mundo real

En un estudio de evidencia del mundo real, la eficacia observada de BLINCYTO® reflejó los datos del estudio clínico
La mayoría de los pacientes en un estudio de mundo real la evidencia era de alto riesgo con anomalías citogenéticas de riesgo desfavorable
Estos datos se derivan de un estudio multicéntrico retrospectivo de 239 pacientes en 11 centros académicos de EE. UU., de los cuales se identificó que 190 pacientes seleccionados comenzaban con BLINCYTO estándar®18 dosificación y ningún tratamiento concomitante (p. ej., TKI, quimioterapia, rituximab o cualquier combinación de estos):
- Se excluyeron de este análisis de subconjunto los pacientes que no recibieron BLINCYTO® para la LLA de células B Ph(–) R/R de acuerdo con la etiqueta de la FDA.
- De los 190 pacientes incluidos en este análisis de subconjunto, 159 tenían LLA de células B Ph(–) R/R. Los 31 pacientes restantes tenían LLA de células B Ph(+) R/R y están excluidos de esta presentación de datos.
*Se incluyeron en el análisis cinco pacientes que no pudieron ajustar la dosis completa debido a la tolerancia.18
Ph(–), cromosoma Filadelfia negativo; Ph(+), cromosoma Filadelfia positivo; TKI, inhibidor de la tirosina quinasa.
En el estudio de evidencia del mundo real, se observó SG en pacientes que recibieron BLINCYTO®18,*,†

*Un paciente no tenía datos disponibles para el análisis de supervivencia y no está incluido en los análisis de supervivencia. Sin embargo, tenga en cuenta que este paciente está incluido en las evaluaciones de toxicidad y respuesta.18
†Estimado desde el momento del inicio del tratamiento con BLINCYTO® hasta la muerte o pérdida durante el seguimiento .18
En el estudio de evidencia del mundo real, se observaron respuestas en pacientes que recibieron BLINCYTO®18,*,†
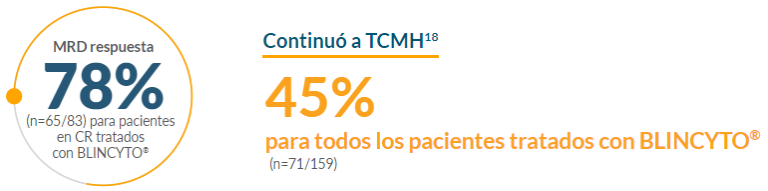
- La EMR se evaluó mediante citometría de flujo en este análisis versus flujo Citometría y PCR en el estudio TOWER. Además, el momento en que No se especificó la evaluación de EMR y CR. En el estudio TOWER, los pacientes fueron evaluados para estos criterios de valoración dentro de las 12 semanas posteriores al tratamiento iniciación18
*No se especificó el momento exacto de la evaluación para este criterio de valoración.18
Vea los resultados de seguridad del estudio histórico TOWER y el estudio de evidencia del mundo real
Características iniciales de los pacientes en el estudio de evidencia del mundo real
| Edad* | |
|---|---|
| Media ± DE, años | 45 ± 17 |
| Rango, años | 8–79 |
| Criterios de ingreso al estudio, n (%) | |
| Refractario a la terapia primaria | 41 (26,6) |
| < 18 meses hasta la primera progresión. | 76 (49,4) |
| Anomalías citogenéticas, n (%) | |
| No | 62 (39,0) |
| Sí | 97 (61,0) |
| ≥ 3 terapias previas, n (%) | 36 (22,8) |
| Trasplante previo, n (%) | |
| Sí | 27 (17,0) |
| No | 132 (83,0) |
| Explosiones de BM al inicio de BLINCYTO®, n (%) | |
| Explosiones de MO ≥ 50%, n (%) | 57 (45,2) |
*En este análisis se incluyeron pacientes pediátricos.
La evidencia del mundo real proporciona datos adicionales fuera de un ensayo clínico que pueden apoyan la elección de BLINCYTO® en adultos con Ph(–) LLA precursora de células B R/R18
R/R Ph(+): ALCÁNTARA

Diseño del estudio: La inmunoterapia como agente único BLINCYTO ® se evaluó en un estudio multicéntrico de fase 2, abierto, de un solo grupo (N=45) en pacientes adultos con LLA de precursores de células B Ph(+) R/R que progresaron después de, o eran intolerantes a la terapia con TKI de segunda o posterior generación y eran intolerantes o refractarios al imatinib. El criterio de valoración principal fue la tasa de CR/CRh* dentro de los 2 primeros ciclos de tratamiento: 36 % (n = 16/45; IC del 95 %: 22–51). 1,19 Criterios de valoración secundarios seleccionados: tasa de respuesta de EMR durante los dos primeros ciclos de tratamiento, SLR, OS, TCMH después de la remisión inducida por BLINCYTO ® . 1,19
BLINCYTO® es un tratamiento eficaz para Precursor de células B Ph(+)
CR/CRh* se logró durante aproximadamente un tercio de pacientes1
Criterio de valoración principal: tasa de RC/CRh* dentro de los 2 primeros ciclos de tratamiento 1,19
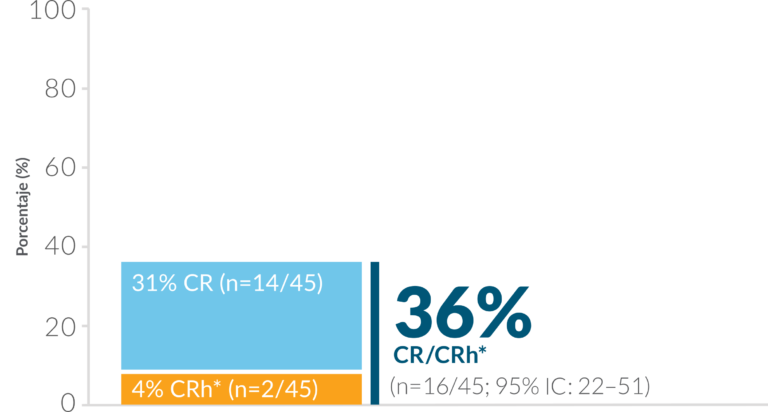
CR se definió como ≤ 5% de explosiones en el BM, no evidencia de enfermedad y recuperación total de los recuentos de sangre periférica (plaquetas>. 100.000/mcL y ANC> 1.000/mcL).1
CRh* Fue definido como ≤ 5% de blastos en la MO, sin evidencia de enfermedad y recuperación parcial de periférico Recuentos sanguíneos (plaquetas > 50 000/mcL y RAN > 500/mcL).1
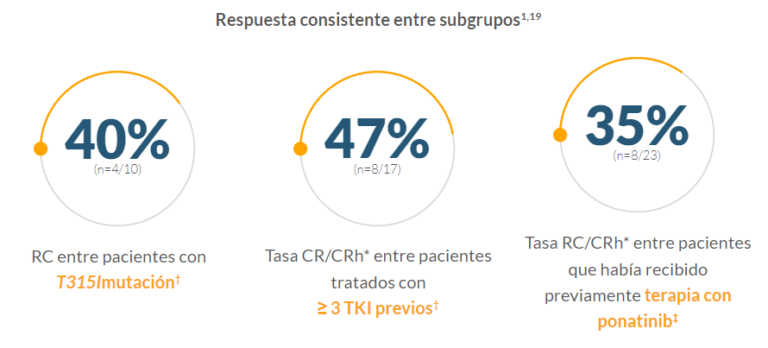
- El 31% de los encuestados (n=5/16) procedieron al TCMH1
CR/CRh* en estos subgrupos fue un análisis preespecificado en ALCANTARA; sin embargo, la eficacia de CR/CRh* en estos subgrupos no fue un objetivo del estudio y el estudio no tuvo el poder estadístico suficiente para evaluar la eficacia de CR/CRh* en estos subgrupos. 20
‡ La respuesta en este subgrupo es un análisis post hoc en ALCANTARA, por lo tanto, la eficacia en este subgrupo no fue un objetivo del estudio y el estudio no tuvo el poder estadístico suficiente para evaluar la eficacia en este subgrupo. 20
ALL, leucemia linfoblástica aguda; RAN: recuento absoluto de neutrófilos; MO, médula ósea; IC: intervalo de confianza; RC: remisión completa; CRh*: remisión completa con recuperación hematológica parcial; TCMH, trasplante alogénico de células madre hematopoyéticas; EMR, enfermedad residual medible o mínima; NCCN, Red Nacional Integral del Cáncer; SG, supervivencia general; Ph(+), cromosoma Filadelfia positivo; SLR: supervivencia libre de recaídas; R/R, recaída o refractaria; TKI, inhibidor de la tirosina quinasa.
La mayoría de los pacientes que logrado CR/CRh* con BLINCYTO® tuvo una respuesta completa de EMR

- La respuesta de EMR se definió como EMR mediante PCR < 1x 10-4
- Todos los pacientes con la mutación T315I que alcanzaron CR/CRh* (n=4/10) fueron EMR negativos dentro los 2 primeros ciclos de tratamiento19
Consulta los datos de seguridad del estudio ALCANTARA
PCR, reacción en cadena de la polimerasa.
Diseño del estudio ALCANTARA y características basales de los pacientes.
Diseño del estudio ALCANTARA: BLINCYTO® se evaluó la inmunoterapia como agente único en un estudio de fase 2 multicéntrico, de un solo brazo y abierto ( N=45) en pacientes adultos con LLA de precursores de células B Ph(+) R/R que progresaron después o fueron intolerantes a la terapia con TKI de segunda o posterior generación y fueron intolerantes o refractarios a imatinib.1,19

Criterio de valoración principal
- CR/CRh* durante los dos primeros ciclos
Criterios de valoración secundarios seleccionados:
- Tasa de respuesta de EMR durante los dos primeros ciclos de tratamiento
- SLR
- SO
- TCMH después de la remisión inducida por BLINCYTO ®
| Criterios clave de inclusión19 |
|---|
| Pacientes ≥ 18 años |
| Recaída después o refractaria a al menos 1 segunda generación o posterior TKI o intolerancia a segunda o TKI de última generación y intolerantes o refractario a imatinib |
| > 5% explosiones de BM |
| Estado funcional ECOG ≤ 2 |
| Criterios de exclusión clave19 |
| TCMH en 12 semanas |
| GvHD activa aguda o crónica de grado 2 a 4 |
| Tratamiento sistémico de GvHD dentro de las 2 semanas anteriores al inicio del tratamiento. |
| Historia o presencia de patología del SNC clínicamente relevante. |
| SNC activo TODOS |
| Enfermedad extramedular aislada |
Población de pacientes difíciles de tratar
- BLINCYTO® fue evaluado en difícil de tratar pacientes, incluidos aquellos con exposición previa a ponatinib, mutación T315l y TCMH previo19
| Sexo, n (%) | |
|---|---|
| Masculino | 24 (53) |
| Grupo de edad, n (%) | |
| 18 a < 55 años | 22 (49) |
| 55 a < 65 años | 11 (24) |
| ≥ 65 años | 12 (27) |
| Exposición previa a TKI, n (%)† | |
| Dasatinib | 39 (87) |
| Imatinib‡ | 25 (56) |
| Ponatinib | 23 (51) |
| nilotinib | 16 (36) |
| T315I mutación, n (%) | 10 (27)§ |
| TCMH previo, n (%) | 20 (44) |
| ≥ 2 tratamientos previos con TKI, n (%) | 38 (84) |
| ≥ 3 tratamientos previos con TKI, n (%) | 17 (38) |