
Elija BLINCYTO® como opción de tratamiento para pacientes pediátricos y AYA con EMR(+) CD19 positivo o células B R/R precursor TODOS
MT103-205, el estudio fundamental de BLINCYTO® en pacientes pediátricos con LLA de precursores de células B R/R: Estudio internacional, abierto, de un solo grupo, de fase 1/2 de BLINCYTO como agente único® en 70 pacientes < 18 años con LLA de precursores de células B y> 25 % de blastos de MO que fueron refractarios primarios, en la primera recaída después de la inducción de rescate total, en la segunda o posterior recaída, o en cualquier recaída después del TCMH. El criterio de valoración principal fue CR/CRh* en los primeros 2 ciclos: 33 % (n=23/70); (IC 95%: 22,1-45,1).1,2,†
†La RC se definió como ≤ 5 % de blastos en la MO, sin evidencia de blastos circulantes o enfermedad extramedular y recuperación completa de los recuentos de sangre periférica (plaquetas> 100 000/ microlitro y RAN > 1.000/microlitro). CRh* se definió como ≤ 5 % de blastos en la MO, sin evidencia de blastos circulantes o enfermedad extramedular y recuperación parcial de los recuentos de sangre periférica (plaquetas > 50 000/microlitro y RAN > 500/microlitro).
R/R: estudio Amgen 20120215

Diseño del estudio: estudio de fase 3, aleatorizado, controlado y abierto, de BLINCYTO® frente a quimioterapia como terapia de consolidación post-reinducción previa. al TCMH en 108 pacientes pediátricos> 28 días y < 18 años de edad con LLA de precursores de células B Ph(–) en primera recaída de alto riesgo.* Después de recibir quimioterapia de reinducción seguida de 2 bloques de quimioterapia de consolidación de alto riesgo,†®3 < 0,001; HR: 0,33 (IC 95%: 0,18-0,61). Criterios de valoración secundarios seleccionados: SG, incidencia de recaída, respuesta de EMR, incidencia de EA.P (n=54) frente al 27% para los pacientes que recibieron quimioterapia (n=54); El criterio de valoración principal fue la SSC: 66 % a los 2 años para los pacientes tratados con BLINCYTO‡ (n=54) o un tercer bloque de quimioterapia de consolidación de alto riesgo ( n=54).® los pacientes fueron aleatorizados para recibir un ciclo de BLINCYTO
*El riesgo alto se definió como una recaída muy temprana o temprana de iBM, una recaída muy temprana combinada de BM + EM o una recaída muy temprana de iEM. La recaída muy temprana se definió como < 18 meses después del diagnóstico primario, y la recaída temprana se definió como ≥ 18 meses después del diagnóstico primario y < 6 meses después de completar la terapia primaria.4
†Terapia de inducción y ciclos de quimioterapia HC1 y HC2 administrados según los protocolos IntReALL HR 2010, ALL-REZ BFM 2002, ALL R3, COOPRALL y AIEOP ALL REC 2003.
‡El tercer bloque de quimioterapia de consolidación, HC3, incluyó: dexametasona IV/vincristina IV/daunorrubicina IV/metotrexato IV/ifosfamida IV/PEG-asparaginasa IV/IM.
BLINCYTO® demostró una SSC superior y una SG mejorada en comparación con la quimioterapia en pacientes pediátricos con LLA de precursores de células B en una primera recaída de alto riesgo
SSC para BLINCYTO® versus quimioterapia 3
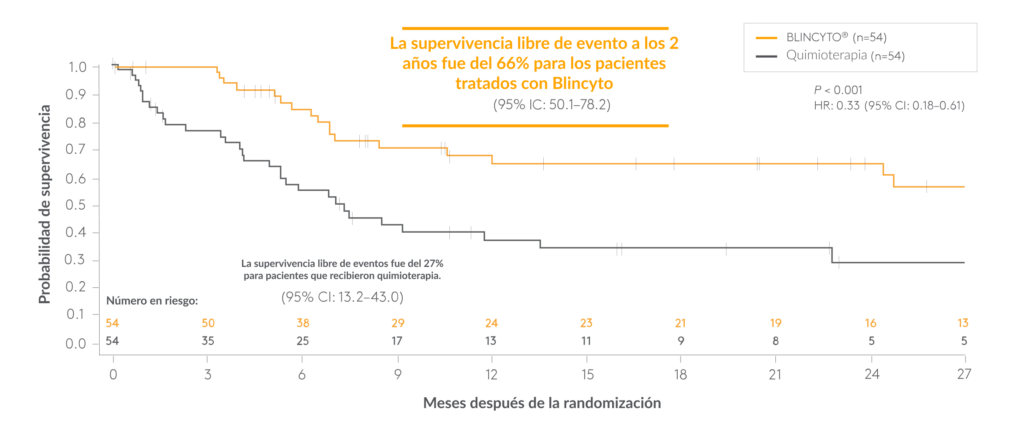
A los pacientes que no lograron la remisión o que murieron antes de la evaluación se les asignó un día de supervivencia libre de eventos. Los pacientes vivos y libres de eventos fueron censurados en su última fecha de evaluación.
- En la mediana de seguimiento de 22,4 meses, la SSC fue del 69 % con BLINCYTO® y del 43 % con quimioterapia< ai=3>3
- Para el estudio 20120215, la EMR se evaluó mediante PCR cuantitativa en tiempo real y citometría de flujo multicolor. La evaluación de la enfermedad residual mínima mediante PCR y citometría de flujo se realizó en paralelo, a menos que el material fuera limitado, en cuyo caso se utilizó la PCR, el método independiente del investigador más sensible y sólido. La PCR se considera el criterio estándar para cuantificar la enfermedad residual mínima y ha sido validada por los grupos de estudio que atienden a pacientes pediátricos y adultos con LLA. No se puede confirmar la validez analítica del ensayo EMR mediante citometría de flujo.3
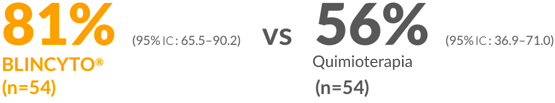
SG a 2 años para BLINCYTO® frente a quimioterapia3
- En la mediana de seguimiento de 19,5 meses, el HR para la SG fue de 0,43 (IC del 95 %: 0,18–1,01)3
EA, evento adverso; SSC: supervivencia libre de eventos; EM, extramedular; HC1, bloque 1 de consolidación de alto riesgo; HC2, bloque 2 de consolidación de alto riesgo; HC3, bloque 3 de consolidación de alto riesgo; HR, índice de riesgo;
IBM, médula ósea aislada; iEM, extramedular aislado; IM, intramuscular; EMR, enfermedad residual medible o mínima; SG, supervivencia general; Ph(–), cromosoma Filadelfia negativo.
La mayoría de los pacientes que recibieron BLINCYTO® lograron EMR negativa* y más pacientes procedieron a un TCMH frente a quimioterapia

Más pacientes que recibieron BLINCYTO® procedieron al TCMH mientras estaban en remisión3
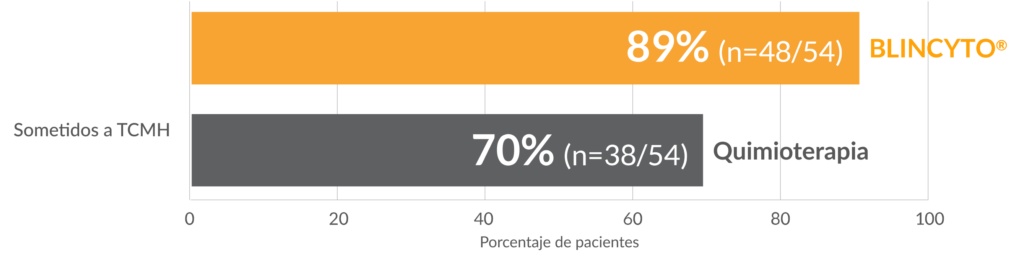
- El número de pacientes que se sometieron a un TCMH mientras estaban en remisión fue parte de un análisis post hoc. El análisis es exploratorio y no se ha ajustado para comparaciones múltiples. No hay conclusiones estadísticas ni clínicas. se puede extraer significado3
*EMR < 10–4, evaluado en un laboratorio central mediante PCR.3
PCR, reacción en cadena de la polimerasa.
Diseño del estudio Amgen 20120215 y características basales de los pacientes.
Pacientes> 28 días y < 18 años de edad con LLA de células precursoras Ph(–) B en primera recaída de alto riesgo3,*

Punto final principal:3
- Supervivencia sin eventos
Puntos finales secundarios seleccionados:3
- Sobrevivencia promedio
- Incidencia de recaída
- Respuesta EMR
- Incidencia de AA
*EMR < 10–4, evaluado en un laboratorio central mediante PCR.3
PCR, reacción en cadena de la polimerasa.
| Criterios clave de inclusión3 |
|---|
| LLA precursora de células B de alto riesgo en la primera recaída |
| < 5 % de explosiones o entre 5 % y 25 % de explosiones en BM |
| Criterios de exclusión clave3 |
| Patología clínicamente relevante del SNC que requiere tratamiento. |
| Evidencia de participación actual del SNC (CNS2, CNS3) por parte de TODOS§ |
| Función renal o hepática anormal antes del inicio del tratamiento. |
La inscripción se cerró anticipadamente debido a la diferencia estadísticamente significativa en la eficacia de BLINCYTO® frente a la quimioterapia en un umbral de eficacia predefinido del 50 % del análisis provisional de eventos de SSC
Características demográficas y clínicas de los niños en la aleatorización en el ensayo de BLINCYTO® versus quimioterapia en primera recaída de alto riesgo
| BLINCYTO ® (n=54) | Quimioterapia (n=54) norte (%) | |
| Edad de inscripción (años) Mediana (rango) | 6 (1-17) | 5 (1-17) |
| 1–9 | 39 (72,2) | 38 (70,4) |
| 10-18 | 15 (27,8) | 16 (29,6) |
| Sexo | ||
| Femenino | 24 (44,4) | 32 (59,3) |
| Masculino | 30 (55,6) | 22 (40,7) |
| Anomalías genéticas en el momento del diagnóstico de la primera recaída de alto riesgo. | ||
| Pronóstico favorable Hiperdiploidía t(12;21) (p13;q22)/TEL-AML1 | 8 (14,8) 6 (11.1) 2 (3,7) | 10 (18,5) 6 (11.1) 4 (7,4) |
| Pronóstico desfavorable** t(v;11q23)/KMT2A reordenado< a i=4>t(1;19)(q23;p13.3)/ E2A-PBX1Hiperdiploidía | 7 (13,0) 2 (3,7) 2 (3,7) 2 (3,7) | 9 (16,7) 6 (11.1) 2 (3,7) 0 (0,0) |
| Pronóstico indefinido | 5 (9,3) | 6 (11.1) |
*El riesgo alto se definió como una recaída muy temprana o temprana de iBM, una recaída muy temprana combinada de BM + EM o una recaída muy temprana de iEM. La recaída muy temprana se definió como < 18 meses después del diagnóstico primario y se definió recaída temprana como ≥ 18 meses después del diagnóstico primario y < 6 meses después de completar la terapia primaria.4
†Terapia de inducción y ciclos de quimioterapia HC1 y HC2, administrados según los protocolos IntReALL HR 2010, ALL-REZ BFM 2002, ALL R3, COOPRALL y AIEOP ALL REC 2003. .3
‡El tercer bloque de quimioterapia de consolidación, HC3, incluyó: dexametasona IV/vincristina IV/daunorrubicina IV/metotrexato IV/ifosfamida IV/PEG-asparaginasa IV/IM.
§CNS2, pacientes con recuento de leucocitos en el LCR < 5 por microlitro y tener explosiones en el LCR; SNC3, pacientes con recuento de leucocitos en el LCR ≥ 5 por microlitro y con blastos en el LCR.5
**Un paciente en el grupo de blinatumomab con IAMP21 y un paciente en el grupo de quimioterapia de consolidación con t(17;19)(q22;p13)/< /span>3 también presentaba una anomalía genética que predecía un pronóstico desfavorable.TCF3-HLF
LCR, líquido cefalorraquídeo; WBC, glóbulo blanco.
R/R: estudio COG AALL1331

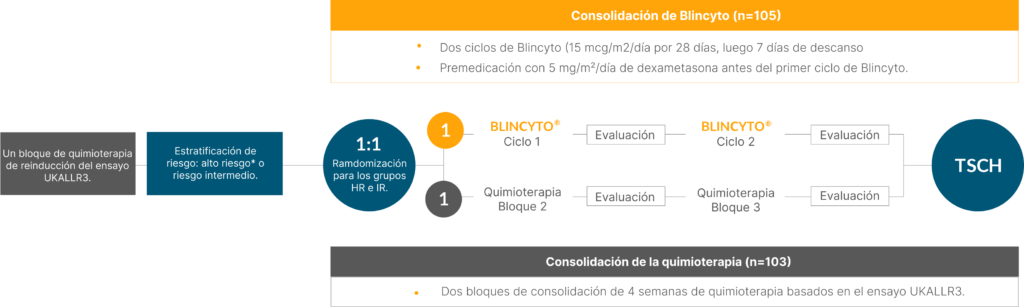
Diseño del estudio: estudio de fase 3, aleatorizado, controlado, abierto, de 208 pacientes de 1 a 27 años de edad con LLA de precursores de células B Ph(–) en primera recaída de precursores de células B de riesgo alto* o intermedio TODO. †,‡ Después de un bloque de quimioterapia de reinducción con UKALLR3, los pacientes de los grupos de riesgo alto e intermedio fueron aleatorizados para recibir los ciclos 1 y 2 de BLINCYTO ® (n=105) como terapia de consolidación posterior a la reinducción o los bloques 2 y 3 de quimioterapia. consolidación (n = 103) basada en el ensayo UKALLR3. § El criterio de valoración principal fue la SSE: 54 % a los 2 años para los pacientes que recibieron BLINCYTO ® (n=105) frente a 39 % para los pacientes que recibieron quimioterapia (n=103); P = 0,03; HR: 0,70 (IC 95%: 0,47-1,03). Criterio de valoración secundario: SG, criterio de valoración exploratorio: respuesta de EMR, criterio de valoración post hoc: capacidad para proceder al TCMH. 5
*Los pacientes que tuvieron una recaída de iBM o una combinación de BM + EM < 36 meses o que tuvieron una recaída de iEM < 18 meses fueron asignados al grupo de alto riesgo. 5
† Los pacientes que tuvieron una recaída de iBM o una combinación de BM + EM ≥ 36 meses o que tuvieron una recaída de iEM ≥ 18 meses y EMR ≥ 0,1% al final de la inducción fueron asignados al grupo de riesgo intermedio. 5
‡ También formó parte del estudio un grupo de aleatorización de bajo riesgo. 5
UKALLR3: inducción, metotrexato IT/dexametasona oral/mitoxantrona IV o idarrubicina IV/vincristina IV/pegaspargasa IM; consolidación, dexametasona oral/vincristina IV/metotrexato IT/metotrexato IV/pegaspargasa IM/ciclofosfamida IV/etopósido IV; mantenimiento, metotrexato IT/dexametasona oral/vincristina IV/citarabina IV/Erwinase IM/metotrexato IV; antes del TCMH, fludarabina IV/citarabina IV/citrato de daunorrubicina liposomal IV. 5,6
ALL, leucemia linfoblástica aguda; MO, médula ósea; CD, grupo de diferenciación; IC: intervalo de confianza; EM, extramedular; HR: índice de riesgo; TCMH, trasplante alogénico de células madre hematopoyéticas; IBM: médula ósea aislada; iEM, extramedular aislado; IM, intramuscular; TI, intratecal; IV, intravenoso; EMR, enfermedad residual medible o mínima; Ph(–), cromosoma Filadelfia negativo; USPI, Información de prescripción de Estados Unidos.
BLINCYTO ®demostró una SSE y una SG mejoradas en comparación con la quimioterapia en pacientes pediátricos y AYA de riesgo alto e intermedio
SSE de 2 años para BLINCYTO® frente a quimioterapia5

OS para BLINCYTO® frente a quimioterapia5
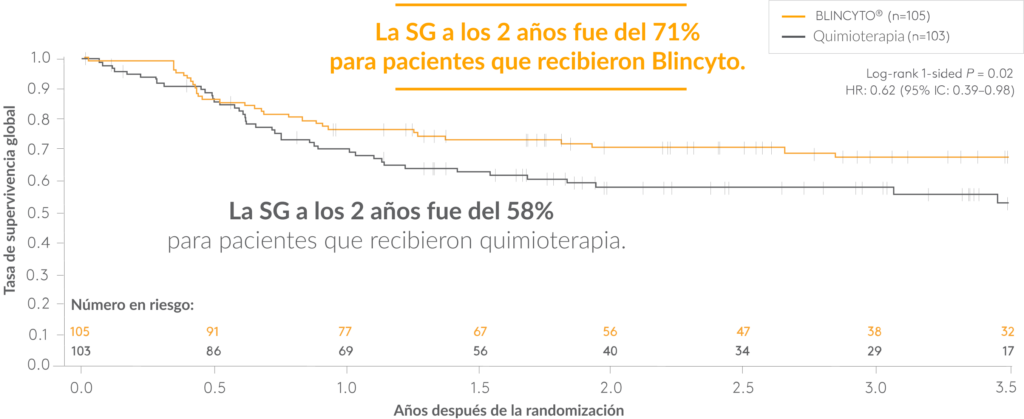
- La mediana de seguimiento fue de 2,9 años5
- El estudio COG AALL1331 también incluyó un grupo de bajo riesgo (LR). En el grupo LR, 127 pacientes elegibles fueron aleatorizados para recibir quimioterapia más BLINCYTO® y 128 pacientes elegibles fueron aleatorizados para recibir quimioterapia sola. La mediana de seguimiento fue de 3,5 años. La tasa de SSE a 4 años fue del 61,2 % ± 5,0 % en el grupo de BLINCYTO® y del 49,5 % ± 5,2 % en el grupo de quimioterapia (HR: 0,76; IC 95%: 0,51-1,14; P = 0,089). La diferencia no fue estadísticamente significativa.7
*Pacientes que tuvieron una recaída de IBM o de una combinación de MO + EM < 36 meses o que hayan tenido una recaída de iEM < Se asignaron 18 meses al grupo de alto riesgo.5
†Los pacientes que tuvieron una recaída de MBi o de MO combinada + ME ≥ 36 meses o que tuvieron una recaída de MBi ≥ 18 meses y EMR ≥ 0,1% al final de la inducción fueron asignados a el grupo de riesgo intermedio.5
COG, Grupo de Oncología Infantil; SLE: supervivencia libre de enfermedad; TCMH, trasplante de células madre hematopoyéticas; SG, supervivencia general; TI, intratecal.
Más pacientes lograron una respuesta de EMR y procedieron a un TCMH con BLINCYTO® frente a quimioterapia

- La respuesta de EMR fue un criterio de valoración exploratorio. El análisis es exploratorio y no se ha ajustado para comparaciones múltiples. No se pueden extraer conclusiones de importancia estadística o clínica5

- Número de pacientes que procedieron a un TCMH mientras estaban en remisión fue parte de un estudio post hoc análisis. El análisis es exploratorio y no se ha ajustado para comparaciones múltiples. No se pueden extraer conclusiones de importancia estadística o clínica5
*Todos los pacientes recibieron un bloque de quimioterapia antes de la aleatorización. Los datos reflejan la respuesta de EMR para los pacientes que recibieron el primer ciclo de BLINCYTO® en BLINCYTO®<. a i=4> brazo de tratamiento frente a pacientes que recibieron el segundo bloque de quimioterapia en el brazo de tratamiento de quimioterapia.5
†EMR < 0,01%, evaluado en laboratorio central mediante citometría de flujo.5
‡En este análisis, se considera que EMR positivo o ningún dato de EMR no tiene EMR negativo. La razón para incluir pacientes sin datos de EMR es que la falta de datos de EMR se debió a muerte, recaída o eliminación del tratamiento del protocolo debido a un EA u otra mala respuesta al tratamiento, por lo que es apropiado incluirlos como lo contrario de el resultado óptimo es poder enviar una muestra y tener EMR negativo.5
Diseño del estudio COG AALL1331 y características iniciales de los pacientes
Pacientes de 1 a 27 años de edad con Ph(–) células B LLA precursora en la primera recaída de riesgo alto o intermedio
Criterio de valoración principal:
Supervivencia libre de enfermedad
Criterio de valoración secundario:
Sobrevivencia promedio
Punto final exploratorio:
Respuesta EMR
Criterio de valoración post hoc:
Capacidad para proceder al HSCT
La inscripción finalizó anticipadamente en los grupos HR e IR debido a fomentar la eficacia y tasas más bajas de toxicidad grave en el grupo BLINCYTO® frente a quimioterapia, basada en una recomendación del Comité Independiente de Monitoreo de Seguridad de Datos
BLINCYTO® fue evaluado en pacientes pediátricos y AYA de riesgo alto e intermedio en la primera recaída
| BLINCYTO ® (n=105) | Quimioterapia (n=103) | |
| Edad de inscripción (años) Mediana (rango intercuartil) | 9 (6-16) | 9 (5-16) |
| 1–9 | 55 (52,4) | 55 (53,4) |
| 10-12 | 10 (9,5) | 11 (10,7) |
| 13-17 | 25 (23,8) | 19 (18,4) |
| 18–20 | 8 (7,6) | 10 (9,7) |
| 21-27 | 7 (6,7) | 8 (7,8) |
| Sexo | ||
| Femenino | 48 (45,7) | 49 (47,6) |
| Masculino | 57 (54,3) | 54 (52,4) |
| Asignación de grupos de riesgo después de la reinducción | ||
| Alto riesgo* | 69 (65,7) | 69 (67,0) |
| Riesgo intermedio† | 36 (34,3) | 34 (33,0) |
| Grupo citogenético al diagnóstico. | ||
| Favorable ETV6-RUNX1, No. Hiperdiploide con +4, +10, No. < /span> | 21 (23,3) 12 9 | 16 (17,6) 8 8 |
| Desfavorable KMT2A-reorganizado, No. Hiperdiploide, No. | 7 (7,8) 7 0 | 10 (11.0) 9 1 |
| Otro Desconocido, No. | 62 (68,9) 15 | 65 (71,4) 12 |
*Pacientes que tuvieron una recaída de IBM o de una combinación de MO + EM < 36 meses o que hayan tenido una recaída de iEM < Se asignaron 18 meses al grupo de alto riesgo.5
†Los pacientes que tuvieron una recaída de MBi o de MO combinada + ME ≥ 36 meses o que tuvieron una recaída de MBi ≥ 18 meses y EMR ≥ 0,1% al final de la inducción fueron asignados a el grupo de riesgo intermedio.5
‡Un grupo de aleatorización de bajo riesgo también formó parte del estudio.5
§UKALLR3: inducción, metotrexato IT/dexametasona oral/mitoxantrona IV o idarrubicina IV/vincristina IV/pegaspargasa IM; consolidación, dexametasona oral/vincristina IV/metotrexato IT/metotrexato IV/pegaspargasa IM/ciclofosfamida IV/etopósido IV; mantenimiento, metotrexato IT/dexametasona oral/vincristina IV/citarabina IV/Erwinase IM/metotrexato IV; antes del TCMH, fludarabina IV/citarabina IV/citrato de daunorrubicina liposomal IV.5
HR, alto riesgo; IR, riesgo intermedio; Ph(+), cromosoma Filadelfia positivo.
R/R: estudio MT103-205

Diseño del estudio: estudio internacional, abierto, de un solo grupo, de fase 1/2 de BLINCYTO como agente único® en pacientes < ; 18 años con> 25% de blastos de MO que fueron refractarios primarios, en la primera recaída después de la inducción de rescate total, en la segunda o posterior recaída, o en cualquier recaída después del TCMH. El criterio de valoración principal fue CR/CRh* en los primeros 2 ciclos: 33 % (n=23/70); (IC 95%: 22,1–45,1).1,2
Aproximadamente un tercio de todos los pacientes lograron CR/CRh* dentro de los primeros 2 ciclos de BLINCYTO ®
El criterio de valoración principal fue CR/CRh* en los primeros 2 ciclos1,†
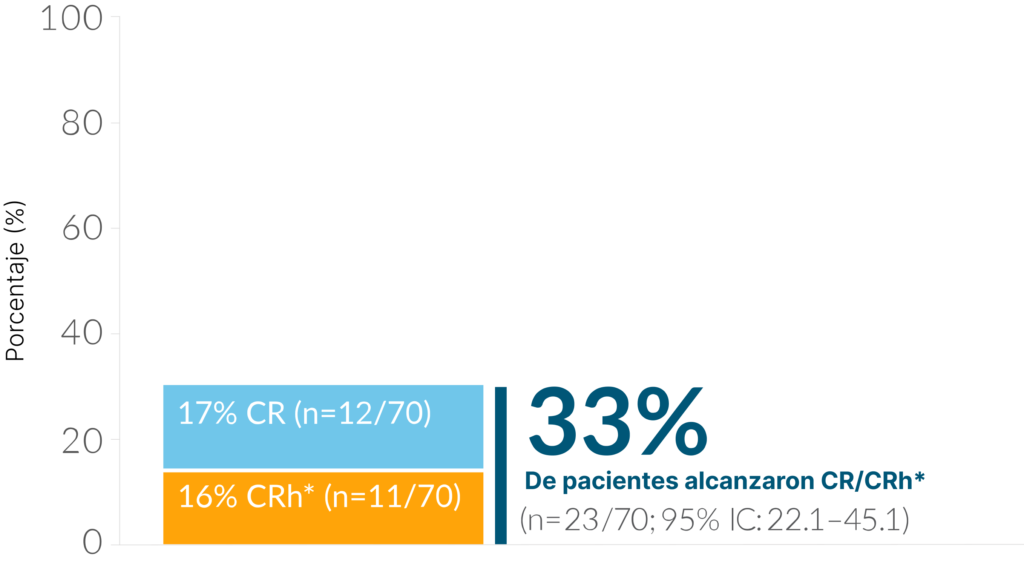
†La RC se definió como ≤ 5 % de blastos en la MO, sin evidencia de blastos circulantes o enfermedad extramedular y recuperación completa de los recuentos de sangre periférica (plaquetas> 100 000/microlitro y RAN > 1.000/microlitro). CRh* se definió como ≤ 5 % de blastos en la MO, sin evidencia de blastos circulantes o enfermedad extramedular y recuperación parcial de los recuentos de sangre periférica (plaquetas > 50 000/microlitro y RAN > 500/microlitro).
ALL, leucemia linfoblástica aguda; RAN: recuento absoluto de neutrófilos; AYA, adolescente y adulto joven; MO, médula ósea; CD, grupo de diferenciación; IC: intervalo de confianza; RC: remisión completa; CRh*: remisión completa con recuperación hematológica parcial; TCMH, trasplante alogénico de células madre hematopoyéticas; NCCN, Red Nacional Integral del Cáncer.
Diseño del estudio MT103-205 y características iniciales de los pacientes.
- Diseño del estudio MT103-205: un estudio internacional, abierto, de un solo brazo, de fase 1/21
BLINCYTO® se estudió como terapia de agente único vía continua Infusión intravenosa2
- Fase 1: búsqueda de dosis
- Fase 2:
- Dosis: 5/15 mcg/m2/día (5 mcg/m2< /span>/día a partir de entonces)2/día durante la primera semana del primer ciclo seguido de 15 mcg/m
- Ciclo de tratamiento: 4 semanas de tratamiento, 2 semanas de descanso
| Criterios de inclusión clave2 |
|---|
| Enfermedad refractaria primaria |
| Primera recaída tras la inducción de rescate total |
| Segunda o posterior recaída, o en cualquier recaída después de un TCMH |
| Edad < 18 años |
| KPS ≥ 50% o LPS ≥ 50% para pacientes < 16 años de edad |
| Criterios de exclusión clave2 |
| EICH activa aguda o crónica extensa después de un TCMH |
| Evidencia de afectación activa del SNC. |
| Evidencia de afectación testicular activa. |
MT103-205 incluido muy pretratado pediátrico pacientes
| Sexo, n (%) | |
|---|---|
| Masculino | 47 (67) |
| Edad, n (%) | |
| < 2 años | 10 (14) |
| 2 a 6 años | 20 (29) |
| 7-17 años | 40 (57) |
| Recaídas previas, n (%) | |
| 0 (enfermedad refractaria primaria) | 2 (3) |
| 1 | 31 (44) |
| 2 | 29 (41) |
| ≥ 3 | 8 (11) |
| TCMH previo, n (%) | 40 (57) |
| Explosiones basales de MO, n (%) | |
| < 50% | 18 (26) |
| ≥ 50% | 52 (74) |
2/día en la fase 1 o fase 2.2
SNC, sistema nervioso central; GvHD, enfermedad de injerto contra huésped; IV, intravenoso; KPS, estado funcional de Karnofsky; LPS, estado funcional de Lansky.
EMR(+): Estudio retrospectivo

BLAST, el estudio fundamental de BLINCYTO® en pacientes adultos con EMR(+) B- LLA de células precursoras: N=86, un estudio abierto de fase 2 de un solo grupo de pacientes adultos con EMR(+) LLA de células B precursoras que habían recibido al menos 3 bloques de quimioterapia de tratamiento estándar para LLA, estaban en remisión hematológica completa (definida como <5% de blastos en la médula ósea, recuento absoluto de neutrófilos> 1 Gi/L, plaquetas> 100 Gi/L) y tenían EMR* en un nivel de ≥ 0,1 % utilizando un ensayo con una sensibilidad mínima del 0,01%. Criterio de valoración principal: En el 81 % (n=70/86) de los pacientes no se evaluó EMR detectable después de 1 ciclo de tratamiento con BLINCYTO®1,8,*
En un estudio retrospectivo (Keating, et al), casi todos los pacientes pediátricos tratados con BLINCYTO® alcanzaron una EMR negativa y posteriormente procedieron a tratamiento hematopoyético alogénico. trasplante de células madre (TCMH).
Un estudio retrospectivo multiinstitucional para informar los resultados utilizando BLINCYTO® como terapia antes del TCMH
- Pacientes pediátricos (N=15) de 0 a 21 años con LLA de precursores de células B EMR(+)9,†
- Todos los pacientes estaban en CR‡ en el momento de la inscripción9
- Dos tercios de los pacientes (10/15) estaban en CR1 y un tercio (5/15) estaban en CR2
- Más de la mitad de los pacientes (9/15) tenían anomalías citogenéticas de riesgo desfavorable9
- El 93 % (n=14/15) de los pacientes no tuvieron ERM detectable después de BLINCYTO® terapia9
- El tiempo medio desde el final del tratamiento con BLINCYTO® hasta el régimen preparatorio para el TCMH fue de 14 días9 (rango: 1 a 35 días)
- Todos los pacientes tuvieron un injerto de neutrófilos exitoso con una mediana de tiempo de 19 días (rango: 11 a 35 días)
- Hay ensayos en curso que investigan BLINCYTO® en pacientes con ERM(+)10
*Definido como la ausencia de EMR detectable confirmada en un ensayo con una sensibilidad mínima de 0,01 % para 6 pacientes y ≤ 0,005 % para 80 pacientes. 65 de 80 pacientes lograron una EMR indetectable con una sensibilidad del ensayo de al menos 0,005 %.1
†La mayoría de los pacientes (n=12) recibieron un único ciclo de 4 semanas de BLINCYTO® a 15 mcg/m2/día; A 2 pacientes se les acortó el ciclo inicial de BLINCYTO® para comenzar la terapia preparatoria para el TCMH (en los días 18 y 20), y 1 paciente recibió 2 ciclos para un total de 66 días.9
‡Definido como < 5% de blastos en la médula ósea.9
§El umbral de positividad de ERM puede variar según el protocolo que se sigue y/o el ensayo que se utiliza.11

Blinatumomab (BLINCYTO®) es el único NCCN Directrices: opción de tratamiento recomendada en consolidación para pacientes adultos con LLA de precursores de células Ph(-) B que tienen persistencia o aumento de la EMR; las Directrices de la NCCN recomiendan «terapia dirigida a eliminar la ERM antes del TCH alogénico», cuando sea posible.?